KH-Absenkung und Wasserpflanzenwachstum - Fakten und Spekulationen
1.) Holländische Anregungen
Infolge einer zufälligen Bekanntschaft mit Aquarianern aus Holland im Jahre 1980 reiste ich mit Freunden in den folgenden Jahren mehrmals nach Zwyndrecht, bzw. wir empfingen Besuch von dort.Wir lernten holländische Aquarienkultur kennen und schätzen. Vor allem aber bekamen die Wasserpflanzen für uns Besucher einen neuen Stellenwert. Wir lernten bei dieser Gelegenheit neben Unterwasser-Gärtnern und Wasserpflege auch das Ansäuern des Aquarienwassers mit Mineralsäure kennen. Hauptsächlich wurde Phosphorsäure benutzt. Mit der Säure wurde ein pH von etwa 6 eingestellt.
Seit etwa 20 Jahren senke ich in einigen Becken den pH-Wert mit Mineralsäure auf etwa 6. Ich benutze allerdings Salzsäure statt Phosphorsäure. Inzwischen pflege ich etwa 40 Arten von Pflanzen und habe den Eindruck, daß die meisten Arten im angesäuerten Wasser besser gedeihen als in Wasser mit einer Karbonathärte von 7, wie z. B. mein Leitungswasser.
2) Eusteralis stellata war mein Problem.
In "Aquarium heute" 2/98 habe ich einen Artikel unter diesem Titel geschrieben und dabei die Bedeutung des Säurezusatzes besonders hervorgehoben. Für mich war allerdings der Tatbestand erstaunlich, daß diese Art und auch andere Arten bei mir nur im angesäuerten Wasser gediehen, während sie bei anderen Aquarianern auch in nicht angesäuertem Wasser gediehen. Ich vermutete den hohen Eutrophierungsgrad meiner Aquarienwässer als Ursache für meine Kulturprobleme.
Unter Eutrophierung verstehe ich vor allem die Anreicherung von Phosphat auf 2 - 5 mg
PO4/l, aber auch die Anreicherung von Nitrat auf 20 - 80 mg NO3/l.
Eine Reihe von Pflanzenarten, wie Eusteralis stellata Standardform, Nesaea crassicaulis,
Alternanthera reinecki, Ammania gracilis und senegalensis u. a. neigen bei mir zum
Veralgen, Lagerosiphon kordofanus neigt zur Knospenbildung. Bei einigen dieser
Arten ist gutes Wachstum durch Ansäuern zu erreichen, bei anderen Arten
muß zusätzlich ein intensiver Wasserwechsel betrieben werden,
wahrscheinlich, um die Konzentration an Phosphor und Stickstoff abzusenken.
3.) Das Ansäuern von Wasser mit Salzsäure
Gieße ich Salzsäure (HCl) in vollentsalztes Wasser und messe den Zusammenhang zwischen Konzentration und pH-Wert, so finde ich in den Grenzen zwischen pH 0 und 5:pH = - lg c HCl
Z. B. messe ich bei der HCl-Konzentration von 1 Millimol/l einen pH-Wert von 3.
2 HCl + Ca(HCO3)2 -> CaCl2 + H2O + 2 CO2
Nehme ich statt des vollentsalzten Wassers Leitungswasser, so wird die Sache verwickelter. Die Salzsäure reagiert zunächst mit dem vorhandenen Hydrogenkarbonat unter Bildung von Kohlendioxid und mäßiger pH-Absenkung.
pH einer angesäuerten Wasserprobe mit und ohne Karbonathärte
| HCl | pH | pH | Bemerkungen |
| Millimol/l | VE-Wasser | LW mit KH 7 | |
| 0 | 5.5 | 7.9 | |
| 0.05 | 4.3 | 7.6 | Säuresturz bei voll- |
| 0.25 | 3.6 | 7.1 | entsalztem Wasser |
| 0.5 | 3.3 | 6.8 | |
| 1 | 3.0 | 6.4 | |
| 1.5 | 2.82 | 6.1 | |
| 2 | 2.7 | 5.6 | |
| 2.5 | 2.6 | Säuresturz bei | |
| 3 | 2.52 | 3.3 | Leitungswasser |
| 4 | 2.4 | 2.8 | |
| 5 | 2.3 | 2.6 | |
| 6 | 2.22 | 2.46 |
Der pH-Abfall wird durch das Hydrogenkarbonat abgepuffert, bis es verbraucht ist. Bei weiterem Ansäuern fällt der pH-Wert wie oben beschrieben.
Habe ich z. B. 1 l Leitungswasser mit der KH von 7, einer CO2-Konzentration von 2,5 mg/l und einem pH-Wert von 7,9 und füge 1 Millimol HCl hinzu, so resultiert ein pH-Wert von 6,4 und eine Erhöhung der CO2-Konzentration um 44 mg/l. Füge ich weiter je 1 Millimol HCl hinzu, so bewegt sich der pH-Wert erst moderat nach unten, dann plötzlich stürzt er. In der Graphik wird das noch deutlicher. Praktiziert man die Entkarbonisierung durch Säure direkt im Aquarium, so besteht die Gefahr einer Überdosierung und schädlicher pH-Absenkung. Auch die Entstehung großer CO2-Mengen muß bedacht werden.Sicherer ist es, das Wechselwasser vorher mit Säure zu versetzen, zu mischen und den pH zu kontrollieren, bevor es ins Aquarium gegeben wird.
4.) Natürliche Entkarbonisierung bei eutrophiertem Altwasser
In stark befütterten Aquarien reichern sich Nitrat und Phosphat an. Wenn man nicht versucht, dem durch regelmäßigen Wasserwechsel entgegenzuarbeiten, kann der Nitratwert auf 20-100 mg/l ansteigen. Damit einher geht eine Entkarbonisierung. Ursache ist die Entstehung von Salpetersäure, einer starken Mineralsäure, aus neutralen Proteinen durch den Stoffwechsel von Fischen und Bakterien. Sie wirkt dann auf das Hydrogenkarbonat ein.2 HNO3 + Ca(HCO3)2 -> Ca(NO3)2 + H2O + 2 CO2
Bis auf die Salpetersäure ist die Gleichung mit der für Salzsäure identisch. Die Nitrifikation führt also zur Absenkung der Karbonathärte und des pH. Ich habe in einigen meiner Altwasseraquarien pH-Werte zwischen 4,5 und 6,5 gemessen. Seltsamerweise waren sie trotz der angeblich fehlenden Pufferung recht konstant, was auf eine konzentrationsabhängige Denitrifikation hinweist, und auf die Wirkung von Mulm und Schlamm als schwach saure Kationentauscher. Die meisten meiner Wasserpflanzen gediehen auch in einem in dieser Art angesäuerten Wasser gut.
5.) Aufnahme von Nährstoffen durch die Wasserpflanzen
Pflanzen nehmen einen großen Teil ihrer mineralischen Nährstoffe aktiv auf, d. h. unter Verbrauch von Energie. Für die Aufnahme besitzen sie verschiedene Organe, die mehr oder weniger selektiv und bedarfsorientiert sind. Z. B. werden Schwermetalle wie Kupfer weit über den tatsächlichen Bedarf hinaus aufgenommen, und das kann dann zu Vergiftungen führen, wenn man zuviel anbietet. Auch nicht-essentielle Stoffe können aufgenommen werden.Ich vermute, daß es auch Verdrängungseffekte bei der Nährstoffaufnahme gibt, wenn eine Ionenart überwiegt, habe dafür aber keine Belege.
Aufkonzentrierung von Nährstoffen durch Pflanzen
| Nährstoff | Konzentrationsfaktor |
| Kalium | 1000 - 10000 |
| Calcium, Magnesium | 1 |
| Kohlendioxid | 1 |
| Nitrat | 50 - 200 |
| Eisen, Mangan, Kupfer, Zink, Kobalt | 1000 - 10000 |
| Phosphat | 100 |
| Molybdat | 1000 |
| Schwefel | 1 |
| Bor | 10 |
Quellen: Nitrat: Eigene Messungen, sonst div. Literatur. Kassebeer 2.98
Die Liste gibt durchschnittliche Aufkonzentrationsfaktoren wieder. In der Nähe des Minimums von essentiellen Nährstoffen entscheidet der bessere Faktor, z. B. bei der Unterdrückung von Algen durch höhere Wasserpflanzen, oder bei der Konkurrenz zweier Pflanzenarten.
Beispiele für Hemmwirkungen durch gelöste Stoffe
| Hemmstoff | Konzentration | Wirkung |
| Hydrogenkarbonat | > 2 °dKH | Stagnation vieler Arten |
| Nitrat | > 20 mg NO3/L | Hemmung der Kaliumaufnahme |
| Phosphat | bei pH > 6,8 > 1 mg PO4/L | Blockierung von Zink und Eisen |
| Schwermetalle | z.B. Cu > 0,1 mg Cu/L | Zerstörung von Stengelpflanzen |
Einige Stoffe wirken beim Stoffwechsel der Pflanzen als Hemmstoffe. Das Wissen um solche Zusammenhänge als allerdings noch nicht bedeutend.
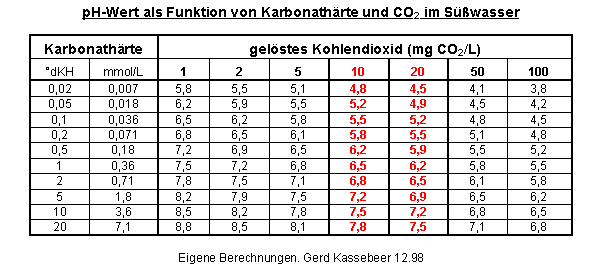
6.) Der Zusammenhang zwischen pH, Karbonathärte und gelöstem Kohlendioxid
Es handelt sich um ein Naturgesetz. Wenn 2 der 3 Größen bekannt sind, ist die dazugehörige dritte festgelegt und durch die Formel oder die Tabelle bestimmbar. Auch der Zusatz von Fremdstoffen macht dieses Gesetz nicht ungültig, lediglich die Naturkonstante pK wird etwas geändert.CO2/HCO3-Gleichgewicht
H+ + HCO3- -> H2O + CO2
pH = pK + lg c HCO3- - lg cCO2
pK ~6,3
Z. B. hat ein Wasser mit 10° Karbonathärte und 20 mg CO2/l einen pH-Wert von 7,2. Blase ich das Kohlendioxid mit Luft aus, so steigt der pH-Wert. Gebe ich H+-Ionen in Form einer starken Mineralsäure hinzu, so senke ich die Karbonathärte (= Hydrogenkarbonatkonzentration) und erhöhe die Kohlendioxidkonzentration. Daraufhin sinkt der pH-Wert, wie das Gesetz es verlangt.
Es ist nicht möglich, eine der 3 Größen zu ändern, ohne daß die anderen auch geändert werden. Allerdings ist es möglich, 2 Größen gleichsinnig zu ändern, ohne daß die dritte geändert wird. Senke ich z. B. die Karbonathärte von 10 auf 1 und die Kohlendioxidkonzentration von 20 auf 2 mg/l, so bleibt der pH-Wert von 7,2 unverändert.
7.) Was bewirkt der Säurezusatz?
Die Tabelle zeigt die Änderung einer Reihe von Faktoren. Die Reduktion der Karbonathärte ist nur einer davon, aber bei wieder konstant gewordener Kohlendioxidkonzentration begleitet von einer pH-Absenkung. Diese wiederum ändert die Löslichkeit von Phosphaten, Karbonaten, Hydroxiden, die Absorption von Kationen und Anionen an Mulm und Schlamm. Die Härte wird nicht oder wenig verändert. Ausgefällte Schwermetalle werden bei niedrigem pH-Wert besser löslich, dafür werden die Fulvosäuren schlechter löslich.Änderungen durch Ansäuern
| Faktor | Formel | Wirkung |
| pH-Wert | pH | Sinkt und ändert die Verfügbarkeit von Mineralstoffen |
| Härte | Ca + Mg | Bleibt konstant oder steigt geringfügig |
| Schwermetalle | Mex+ | Löslichkeit steigt |
| Hydrogenkarbonat | HCO3 | Wird drastisch reduziert |
| Chlorid | Cl | Wird drastisch erhöht |
| Nitrat | NO3 | Denitrifikation wird gehemmt |
| Phosphat | HPO4 + H2PO4 | Verschiebung vom HPO4 zum H2PO4 |
| Kohlendioxid | CO2 | vorübergehend auf gefährliche Werte |
| Ionendiagramm | - | Ionendiagramm |
| Salinität | Leitfähigkeit | LF Steigt geringfügig an |
Das Chlorid ist ein spät entdecktes Spurenelement. Es kann gut sein, daß die eine oder andere Pflanze bei der Konkurrenz um das Chlorid auf der Strecke bleibt. Das wiederum könnte die positive Wirkung des Wasserwechsels erklären helfen.
Die Nitratatmung, die im Altwasseraquarium zur Stabilität des pH-Werts beiträgt, ist bei pH-Werten von unter 6 gehemmt. Das wiederum führt im Zusammenhang mit der Nitrifikation zu einer weiteren Entkarbonisierung und der Stabilisierung eines niedrigen pH-Werts. Bei pH 6,8 ist Hydrogen- und Dihydrogenphosphat im Gleichgewicht. Das Hydrogenphosphat bildet zahlreiche schwerlösliche Schwermetallsalze, das Dihydrogenphosphat nicht. Senkt man den pH-Wert, so gehen die ausgefällten Phosphate in Lösung.
Im Ionendiagramm wird ein einwertiges Anion durch ein anderes ersetzt. Falls das Ionendiagramm überhaupt einen Wachstumsfaktor im weiteren Sinne darstellen sollte, dann ist das Ansäuern mit Salzsäure vermutlich nicht relevant.
Die Salinität steigt geringfügig, weil die spezifische Ionenleitfähigkeit des Chlorids etwas höher ist als die des Hydrogenkarbonats, und weil die Gesamtkonzentration der Ionen praktisch konstant bleibt.
.gif)