Wie kommt der pH-Wert des Aquarienwassers eigentlich zustande?
Ist er das Resultat der Wasserzusammensetzung?
Welche Bedeutung hat der pH-Wert für den Aquarianer?
Ich gehe davon aus, daß die meisten Aquarianer nicht in der Lage sind den pH ihres Aquarienwassers zu messen, daß sie es darüberhinaus auch nicht für nötig halten. Der Meinung bin ich auch. Die weitaus meisten im Handel befindlichen Zierfische vertragen den pH, der sich in einem normalen Aquarium einstellt. Einige Pflanzenarten sind auch sehr tolerant bzw. hart im Nehmen. Begnügt sich der Liebhaber mit der Haltung dieser Fische und Pflanzen, so mag er auch weiterhin den pH seines Aquarienwassers ignorieren!Will er aber etwas anspruchsvollere Pflanzen zum Wachsen bringen, oder Fische aus dem Weichwasserbereich zur Nachzucht, oder will er ein "optimales" Aquarium, was immer man darunter verstehen mag, dann kommt er nicht daran vorbei, sich mit dem pH und seiner Messung zu beschäftigen. Mir geht es diesmal vor allem darum, aufzuzeigen, daß der pH eines Aquarienwassers lediglich das Resultat seiner Zusammensetzung ist, und daß eine Fülle von biologischen, chemischen und physikalischenVorgängen ihn beeinflußt.
So ist der pH definiert
Als ich dieses Thema vor einigen Jahren erstmals zum Inhalt eines Artikels machte, vermied ich sorgfältig den mathematischen Gehalt dieses Begriffs, um mir die Leserschaft zu erhalten, der der Logarithmus nicht geläufig ist. Diesmal versuche ich es auch den Lesern recht zu machen, die wissen, daß der pH der negative Logarithmus der Wasserstoffionenkonzentration in Gramm-Mol H+-Ionen pro Liter ist. Nun ist es heraus!1 Gramm-Mol H+-Ionen wiegen ziemlich genau 1 Gramm. pH 7 bedeutet demnach eine Wasserstoffionenkonzentration von 10-7 Gramm pro Liter oder 0,1 ppb (parts per billion = Teile pro Milliarde). Das ist ganz schön wenig! pH 6 sind das Zehnfache, pH 8 ein Zehntel usw. Die OH- -Ionen möchte ich diesmal auslassen, aber darauf hinweisen, daß die H+ -Ionen im Aquarium nur ein winziger Bruchteil aller Ionen sind. Die Reaktionsgleichung: CO2 + H2O ↔ H+ + HCO3-
Der Doppelpfeil bedeutet, daß es sich um ein Gleichgewicht handelt, daß bei Zugabe einer Komponente sich auch die Konzentration einer oder mehrerer anderer Komponenten ändert. Dafür gilt folgende Formel:
| Konz.(H+) x Konz.(HCO3-) | |
| KDiss.. = | |
| Konz.(CO2) |
KDiss. bedeutet hier die Dissoziationskonstante. Sie beträgt bei
einem Leitungswasser mit 10°dH und 25°C 5,32x10-7, wenn man
die Konzentrationen in Mol/Liter angibt. Gibt man Kohlendioxid in ppm (= mg/l) und
Hydrogencarbonat in °dKH an, so beträgt sie 3,39x10-8.
Mit dieser Konstante ist auch die beigefügte
Tabelle berechnet worden. Wer sich in Logarithmen auskennt, kann die Gleichung auch in
folgender Form anwenden:
pH = 7,47 + lg °KH - lg ppm CO2
7,47 ist der negative Logarithmus der Dissoziationkonstante (pK-Wert).
Mit einem Taschenrechner und dieser Gleichung kann man jeweils aus zwei bekannten Größen die dritte ausrechnen. Mit etwas verminderter Genauigkeit geht das auch mit der Tabelle.
Diese Formel sagt aber auch aus, daß zwei gegebene Konzentrationen die dritte bestimmen. Dies ist ein Naturgesetz, daran läßt sich nicht biegen!
Tabelle 1: pH-Wert als Resultat von Karbonathärte und Kohlendioxidgehalt
| Karbonathärte | Kohlendioxidgehalt (ppm) | ||||||
| (°dKH) | 1 | 2 | 5 | 10 | 20 | 50 | 100 |
| 0.01 | 5.5 | 5.2 | 4.8 | 4.5 | 4.2 | 3.8 | 3.5 |
| 0.02 | 5.8 | 5.5 | 5.1 | 4.8 | 4.5 | 4.1 | 3.8 |
| 0.05 | 6.2 | 5.9 | 5.5 | 5.2 | 4.9 | 4.5 | 4.2 |
| 0.1 | 6.5 | 6.2 | 5.8 | 5.5 | 5.2 | 4.8 | 4.5 |
| 0.2 | 6.8 | 6.5 | 6.2 | 5.8 | 5.5 | 5.2 | 4.8 |
| 0.5 | 7.2 | 6.8 | 6.5 | 6.2 | 5.8 | 5.5 | 5.2 |
| 1 | 7.5 | 7.2 | 6.8 | 6.5 | 6.2 | 5.8 | 5.5 |
| 2 | 7.8 | 7.5 | 7.2 | 6.8 | 6.5 | 6.2 | 5.8 |
| 5 | 8.2 | 7.8 | 7.5 | 7.2 | 6.8 | 6.5 | 6.2 |
| 10 | 8.5 | 8.2 | 7.8 | 7.5 | 7.2 | 6.8 | 6.5 |
Einige Beispiele
Nehmen wir das Leitungswasser: Bei mir kommt es mit pH 7,5 und 7°dKH aus der Leitung. Wende ich obige Gleichung an, so resultiert ein Kohlendioxidgehalt von 6,5 ppm. Belüfte ich dieses Wasser einige Stunden, so steigt der pH auf 8,3, was rechnerisch 1 ppm CO2 entspricht. Bringe ich dieses Wasser durch Zufügen von Kohlendioxid auf pH 7, zum Beispiel mit einer pH-Regelanlage, so enthält es 21 ppm CO2. Allen drei Beispielen ist gemeinsam, daß die Karbonathärte konstant bleibt. Nun nehmen wir Leitungswasser und säuern es tropfenweise mit Salzsäure auf pH 4 an. Dabei wird die Karbonathärte fast vollständig in Kohlendioxid verwandelt nach folgender Formel:HCO3- + H+ ↔ CO2 + H2O
7°dKH ergeben 110 ppm CO2, dazu kommen 6,5 ppm CO2, die schon vorher im Wasser waren. Nach obiger Gleichung hat das Wasser nun eine Karbonathärte von 0,04°dKH. Blasen wir jetzt das Kohlendioxid mit viel Luft aus bis auf einen Restgehalt von 1 ppm, so steigt der pH auf 6,1, und die Karbonathärte bleibt konstant. Gebe ich jetzt pro Liter Wasser 210 mg Natriumhydrogencarbonat hinzu, was 7°dKH entspricht, steigt der pH auf 8,3 wie im belüfteten Ausgangswasser, nur daß es jetzt zusätzlich 146 mg/l Natriumchlorid enthält, die sich aus Salzsäure und Natriumhydrogencarbonat gebildet haben.
Bei diesen Beispielen habe ich alle anderen Wasserinhaltsstoffe ignoriert. Das ist erlaubt, solange deren Gesamtkonzentration niedrig ist, und das ist hier der Fall. In Seewasser zum Beispiel ergibt sich wegen der hohen Konzentration an Natriumchlorid eine andere Dissoziationskonstante. Phosphorsäure und lösliche Huminsäuren wirken sich bei der Anwendung von Tabelle und Gleichung nicht aus, sie erschweren lediglich die Bestimmung von Karbonathärte und freiem CO2, indem sie jeweils Plusfehler verursachen. Will man zum Beispiel ein Altwasser mit einem pH von 5 auf Karbonathärte untersuchen, so empfiehlt sich eine Blindwertermittlung bei der CO2-Messung, indem der Tropftest oder die Titration einmal auf die nicht vorbehandelte Probe und einmal auf die durch Belüftung von CO2 befreite Probe angewandt wird, wobei die Differenz dem CO2-Gehalt entspricht.
Aquaristische Einflüsse auf das H+/CO2/HCO3--Gleichgewicht.
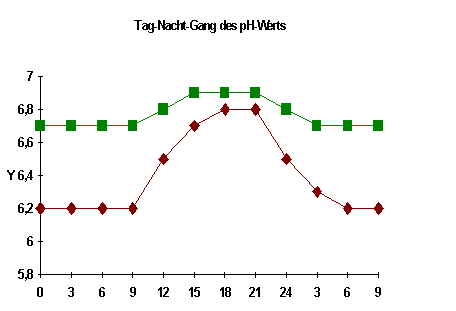
Messen oder registrieren wir den pH-Wert eines Aquariums ohne pH-Regelung, so stellen wir einen ausgeprägten Tagesgang fest, vor allem bei Becken ohne Belüftung und ohne Rieselfilter.Der eine Kurvenzug kommt zustande durch den dominierenden CO2-Verbrauch der assimilierenden Pflanzen bei Beleuchtung am Tage sowie die dominierende CO2-Produktion der Bakterien in der dunklen Phase. Bei starker Belüftung verflacht sich die Kurve sehr stark, weil jetzt das Austragen von CO2 der dominierende Vorgang ist (zweiter Kurvenzug). Beim Tagesgang kann man annehmen, daß die Karbonathärte konstant bleibt.Das ist, über eine längere Periode betrachtet, häufig nicht der Fall. Vor allem die mineralisierten Stoffwechselprodukte der Fische können die Karbonathärte reduzieren. Der in den Proteinen des Fischfutters enthaltene Stickstoff wird letztendlich zu Salpetersäure mineralisiert. Daneben spielen andere Mineralstoffe wie Kalium, Calcium, Magnesium, Schwefel, Phosphor eine deutlich geringere Rolle. Die Salpetersäure wirkt auf das Hydrogencarbonat wie die Salzsäure. Die Karbonathärte wird reduziert und damit der pH. Das kann bei stark belasteten Becken zu pH-Werten zwischen 4 und 5 führen. Theoretisch müßte das noch weiter führen, wurde von mir aber noch nie beobachtet. Im Gegenteil: Manche Aquarien haben unabhängig von Wasserpflegemaßnahmen konstante pH-Werte um 7, andere um 5.
pH-geregelte Denitrifikation
Es gibt nur eine Erklärung für dieses Phänomen, nämlich eine pH-geregelte Denitrifikation. Wie schon ausgeführt wurde, reduziert die Salpetersäure, die aus dem stickstoffhaltigen Fischfutter entsteht, die Karbonathärte. Die Denitrifikation erhöht sie dagegen, weil das in Stickstoff verwandelte Nitrat freie Kationen hinterläßt, die mit CO2 Hydrogencarbonat bilden.Ca(NO3)2→N2 + O2 + Ca2+
Ca2+ + CO2 + H2O ↔ Ca(HCO3) 2 + 2 H+
Im Wasser solcher Becken muß eine größere Menge an Bakterienschlamm vorhanden sein. Die denitrifizierende Bakterienflora entnimmt dem Nitratvorrat soviel Nitrat, wie hinzukommt. Dadurch bleibt die Karbonathärte und damit der pH konstant. Aus der neueren Literatur ist bekannt, daß die nitrifizierenden Bakterien auch denitrifizieren können, da bei beiden Vorgängen die gleichen Enzyme gebraucht werden. Der entscheidende Unterschied ist das Fehlen von Sauerstoff und das Vorhandensein von Bakteriennahrung bei der Denitrifikation. Für diese Hypothese spricht, daß in einem über mehrere Monate eingefahrenen Aquarium der pH nach Wasserwechsel, Füttern oder Ansäuern nach Stunden oder Tagen immer wieder den ursprünglichen Wert erreicht.Auch wenn man ein Becken, das bei pH 4,5 läuft, auf pH 7 bringen will, gelingt das immer nur für Tage, und umgekehrt.
Wenn die Denitrifikation pH-geregelt ist, müßte bloßes Ansäuern zu einer allmählichen Absenkung führen. Das ist leider nicht der Fall. Langsam stellt sich der ursprüngliche pH wieder ein, aber das ist alles! Das Betreiben fast verstopfter Filter bringt eine Nitratsenkung, ist aber keine für den Dauergebrauch geeignete Methode.
Was kann man mit dem pH-Wert anfangen?
Der pH informiert uns stets über das Verhältnis von gelöstem Kohlendioxid und Karbonathärte. Ist außer dem pH eine weitere Konzentration bekannt, so kann mit der Tabelle oder Formel zuverlässig die andere ermittelt werden. das ist vor allem bei sehr niedrigen Karbonathärten interessant, die nicht mehr direkt ermittelt werden können.Eine andere Anwendung ist die indirekte Bestimmung des gelösten Kohlendioxids aus pH und Karbonathärte. Das ist wiederum bei sehr niedrigen Kohlendioxidgehalten der Fall, die direkt nicht mehr bestimmt werden können. Die Tag-Nacht-Schwankungen des pH-Werts erlauben sogar, abzuschätzen, wieviel Kohlendioxid am Tage assimiliert bzw. nachts gebildet wird. Insgesamt soll der beschriebene Zusammenhang das Verständnis für die Vorgänge im Aquarium vertiefen!